Vytváření zcela nových tkáňových náhrad
Obecný princip vytvoření tkáňové náhrady, obsahující umělý materiál jako analog extracelulární matrix (ECM) a buňky
Materiál takto konstruované tkáňové náhrady je resorbovatelný, tj. bude postupně odbouráván a nahrazován regenerovanou tkání. Tak se umělý materiál v moderním tkáňovém inženýrství stává nikoli trvalou náhradou poškozené tkáně, ale pouze dočasným nosičem buněk navozujícím regeneraci poškozené tkáně. Koncentrace a rozmístění adhezních oligopeptidů, tj. ligandů pro adhezní receptory buněk, reguluje počet a plochu rozprostření adherovaných buněk. Aminokyselinové složení oligopeptidů pak určuje typ uchycených buněk. Například sekvence REDV (Arg-Glu-Asp-Val) je preferována endotelovými buňkami, sekvence VAPG (Val-Ala-Pro-Gly) hladkými svalovými buňkami, sekvence KRSR (Lys-Arg-Ser-Lys) osteoblasty a sekvence RGD (Arg-Gly-Asp) váže všecky buněčné typy.
V našich studiích jsme uvedený model použili pro tkáňové inženýrství cévní stěny. Polymerní materiál s oligopeptickými ligandy obsahujícími RGD (ligandy pro integrinové adhezní receptory) byl osazen hladkými svalovými buňkami (HSB), které jsou nejpočetnějším buněčným typem cév, zajišťujícím především jejich kontraktilitu.
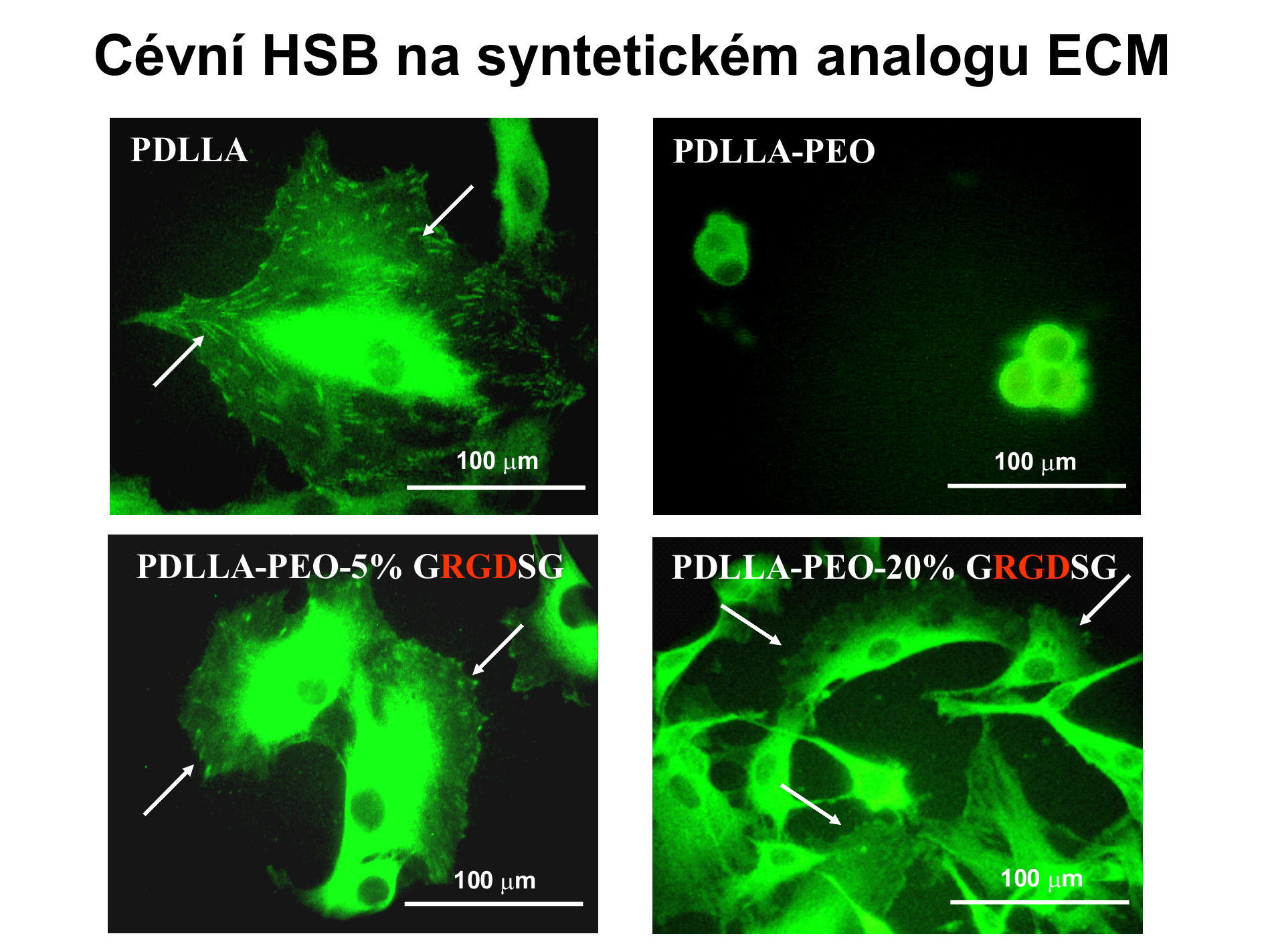
V kultuře na polylaktidu (PDLLA) v médiu doplněném fetálním telecím sérem jsou hladké svalové buňky (HSB) normálně rozprostřeny a zaujímají polygonální tvar, podobně jako je tomu i na standardních polystyrénových kultivačních miskách. Buňky mají dobře vytvořené fokální adhezní plaky (označené šipkou), tj. seskupení adhezních receptorů a dalších asociovaných molekul, pomocí kterých buňky adherují k podložce. Adheze buněk je zprostředkována spontánní adsorpcí proteinů ze séra (především vitronektinu a fibronektinu) k polylaktidu, ke kterým se buňky vážou adhezními receptory.
Jestliže je polylaktid kopolymerizován s řetězci polyetylén oxidu (PDLLA-PEO), stává se povrch materiálu silně hydrofilním a mobilním. Mobilitu si lze představit tak, jako že řetězce PEO „vlají“ v kultivačním médiu podobně jako trávník či lán obilí ve větru. Tím je zabráněno adsorpci proteinů zprostředkujících adhezi buněk ze séra v kultivačním médiu a buňky nemohou adherovat k podložce. Mají kulovitý tvar a nedostatečnou adhezi buňka-materiál se snaží kompenzovat adhezí buňka-buňka, tj. vytvářením shluků.
Jestliže jsou některé řetězce PEO (v tomto případě 5 nebo 20%) osazeny adhezními oligopeptidy s obsahem RGD (PDLLA-PEO-5% GRGDSG nebo PDLLA-PEO-20% GRGDSG), adheze buněk, jejich rozprostření na podložce a tvorba fokálních adhezních plaků jsou obnoveny. Koncentrace adhezních ligandů ovlivnila plochu rozprostření buněk a počet adherujících buněk v tom smyslu, že plocha rozprostření byla vyšší při nižší koncentraci ligandů, kdežto počet buněk byl přímo úměrný koncentraci ligandů.
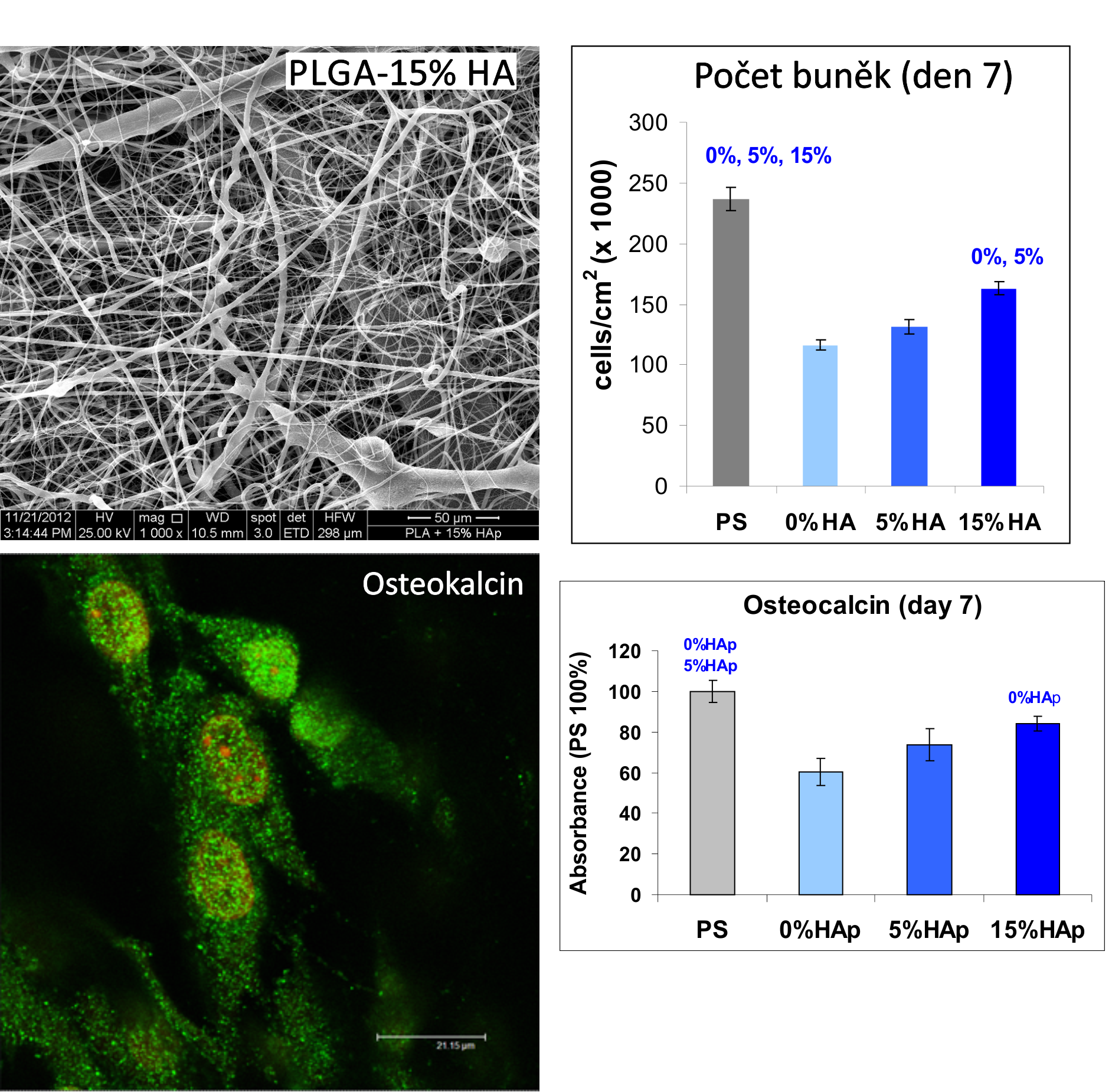
Uvedený princip tvorby tkáňové náhrady by však bylo možno použít obecně pro inženýrství širokého spektra tkání, včetně tkáně kostní. Polymerní materiály jsou však všeobecně méně vhodné pro konstrukci náhrad kostní tkáně pro své nedostatečné mechanické vlastnosti. Proto jsme se pokusili vyztužit polymery tvrdšími materiály, jako jsou nanočástice diamantu či keramických materiálů, např. hydroxyapatitu. Tyto nanočástice představují anorganickou (minerální) složku přirozené kostní tkáně. Polymery jsme použili ve formě nanovláken, která dobře napodobují organickou složku přirozené kostní tkáně, např. vlákna kolagenu.
Potenciální náhrady kostní tkáně na podkladě polymerních nanovláken vyztužených anorganickými částicemi
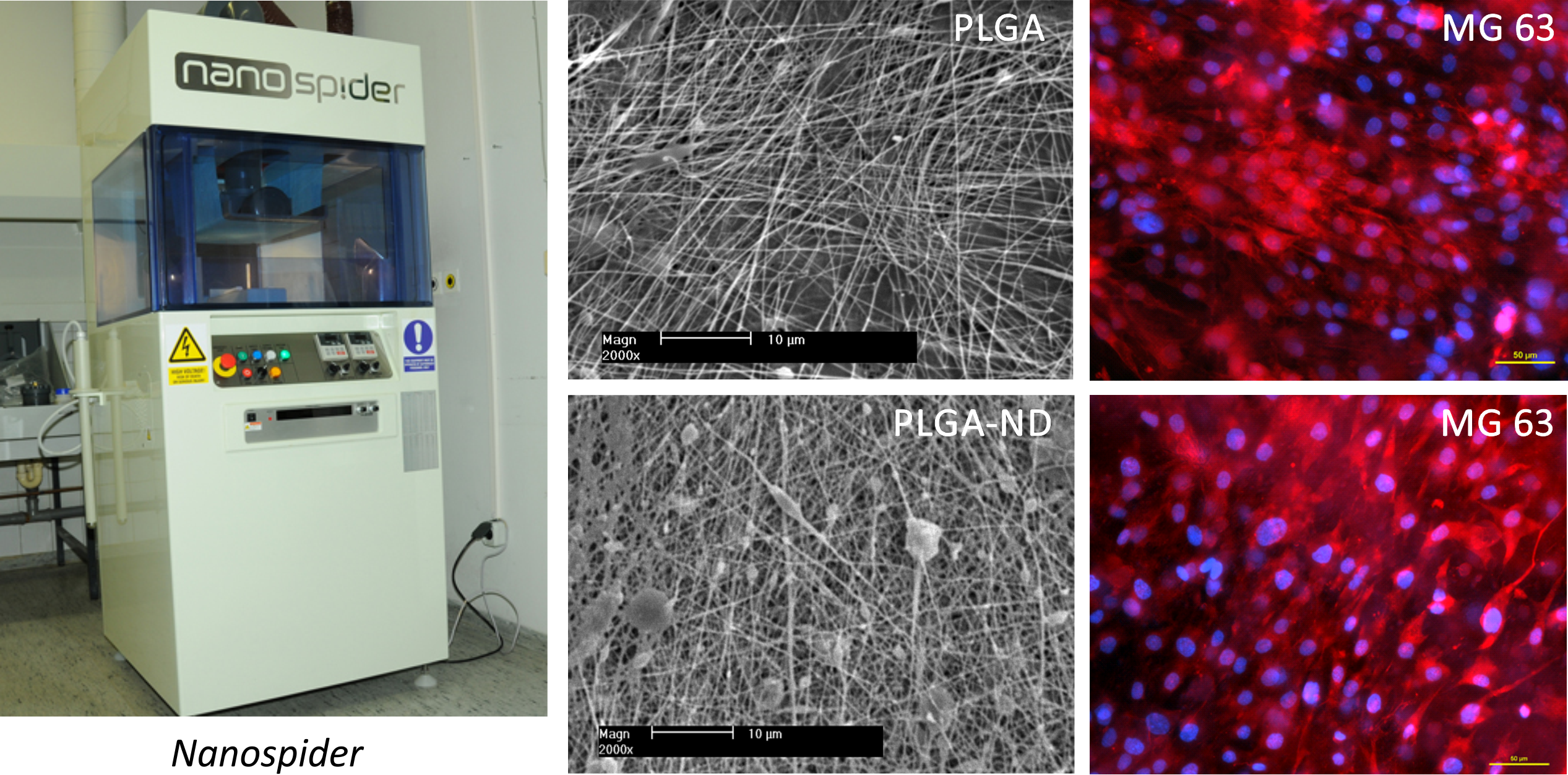
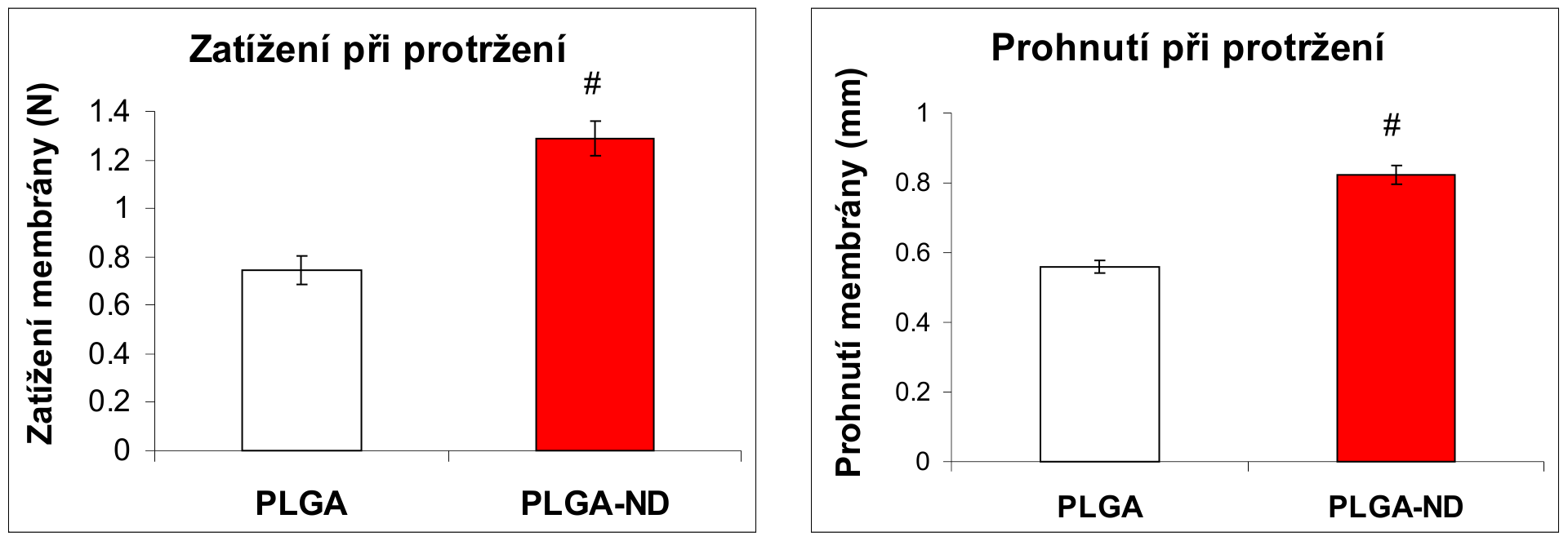
Nanovlákenné sítě z kopolymeru laktidu a glykolidu (PLGA) byly připraveny metodou elektrostatického zvlákňování na přístroji Nanospider (Elmarco s.r.o.). Některé sítě byly vyztuženy nanočásticemi diamantu, přimísenými do roztoku PLGA před zvlákňováním (PLGA-ND). Výsledná koncentrace nanodiamantu v PLGA činila cca 23 hmotnostních %. Lidské osteoblasty linie MG 63 adherovaly a rostly na obou typech sítí obdobnou měrou, ale sítě vyztužené nanodiamanty byly mechanicky odolnější (protrhávaly se až při působení větší síly a při větším prohnutím než nevyztužené sítě).
Příznivých výsledků bylo dosaženo i s nanovlákennými sítěmi z polylaktidu (PLLA) vyztuženými 5 a zejména 15 hmotnostními % hydroxyapatitu (HA). Přítomnost HA podporovala růst osteoblastů linie MG 63 a rovněž jejich osteogenní diferenciaci, která se projevovala vyšší koncentrací osteokalcinu v těchto buňkách: