Objasnění molekulární podstaty interakce proteinu 14-3-3 aktivujícího trehalasu Nth1 v buňkách kvasinek
Výzkumný tým Veroniky Obšilové z Fyziologického ústavu AV ČR a Tomáše Obšila z Přírodovědecké fakulty UK objasnil mechanismus, kterým bílkovina 14-3-3 reguluje funkci kvasničného enzymu neutrální trehalasy Nth1.
Neutrální trehalasa Nth1 katalyzuje hydrolýzu disacharidu trehalosy a představuje jeden z klíčových enzymů energetického metabolismu kvasinek. Výsledky jejich výzkumu, který probíhal výhradně v České Republice, nyní publikoval prestižní americký vědecký časopis Proceedings of the National Academy of Sciences of the USA (PNAS). „Vyřešená atomární struktura komplexu proteinu 14-3-3 s neutrální trehalasou Nth1 ukazuje schopnost proteinu 14-3-3 ovlivňovat konformaci multidoménového enzymu a fungovat jako tzv. alosterický regulátor. Jedná se o teprve druhou známou strukturu komplexu proteinu 14-3-3 s navázaným plně funkčním enzymem,“ říká Veronika Obšilová.
Vědcům z Prahy se podařilo objasnit krystalové struktury několika forem enzymu neutrální trehalasy Nth1 a popsat změny, ke kterým dochází v důsledku vazby ligandu a regulačního proteinu 14-3-3. Ukázali, že enzymová aktivita Nth1 je podmíněna správnou vzájemnou prostorovou orientací katalytické a vápník-vázající domény Nth1, která umožňuje stabilizaci katalytického centra enzymu. Zúročili tak dlouhodobý výzkum zaměřený na pochopení mechanismu regulace kvasničné trehalasy.
„Podařilo se nám rozklíčovat strukturní podstatu aktivace enzymu Nth1 pomocí proteinu 14-3-3. Porovnání struktury komplexu 14-3-3:Nth1 s ostatními 14-3-3 komplexy potvrzuje, že proteiny 14-3-3 ovlivňují strukturu a tím i funkci řady jiných proteinů důležitých pro regulaci klíčových dějů v buňce,“ vysvětluje Veronika Obšilová.
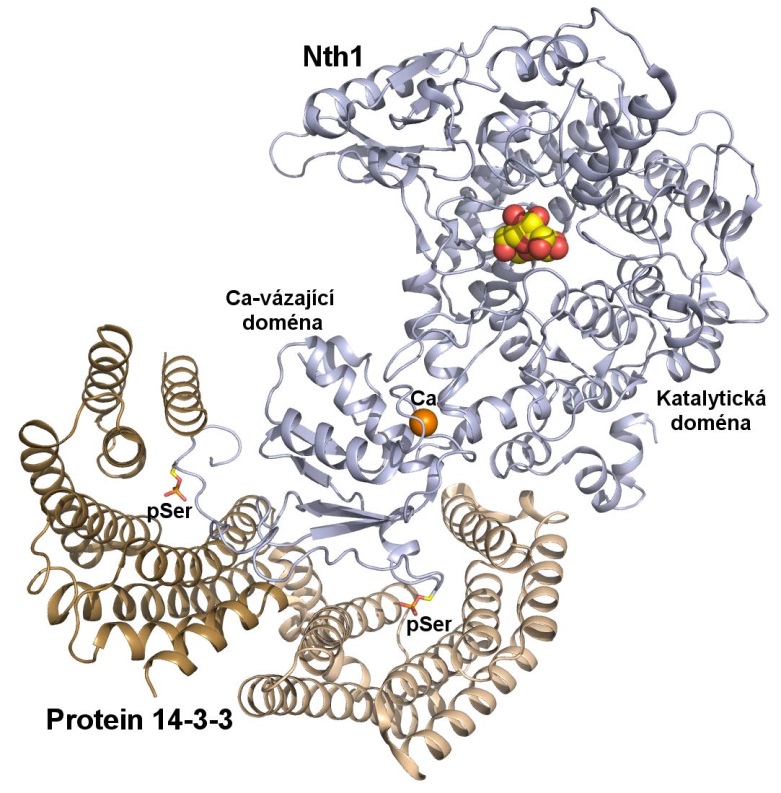
Detailní pohled na strukturu komplexu proteinů 14-3-3 a Nth1 (PDB 5M4A).
Alblova M, Smidova A, Docekal V, Vesely J, Herman P, Obsilova V, Obsil T. Molecular basis of the 14-3-3 protein-dependent activation of yeast neutral trehalase Nth1. Proc Natl Acad Sci U S A. 2017 Nov 14;114(46):E9811-E9820. IF = 9.66.
